Bảng tuần hoàn hòa học là gì?
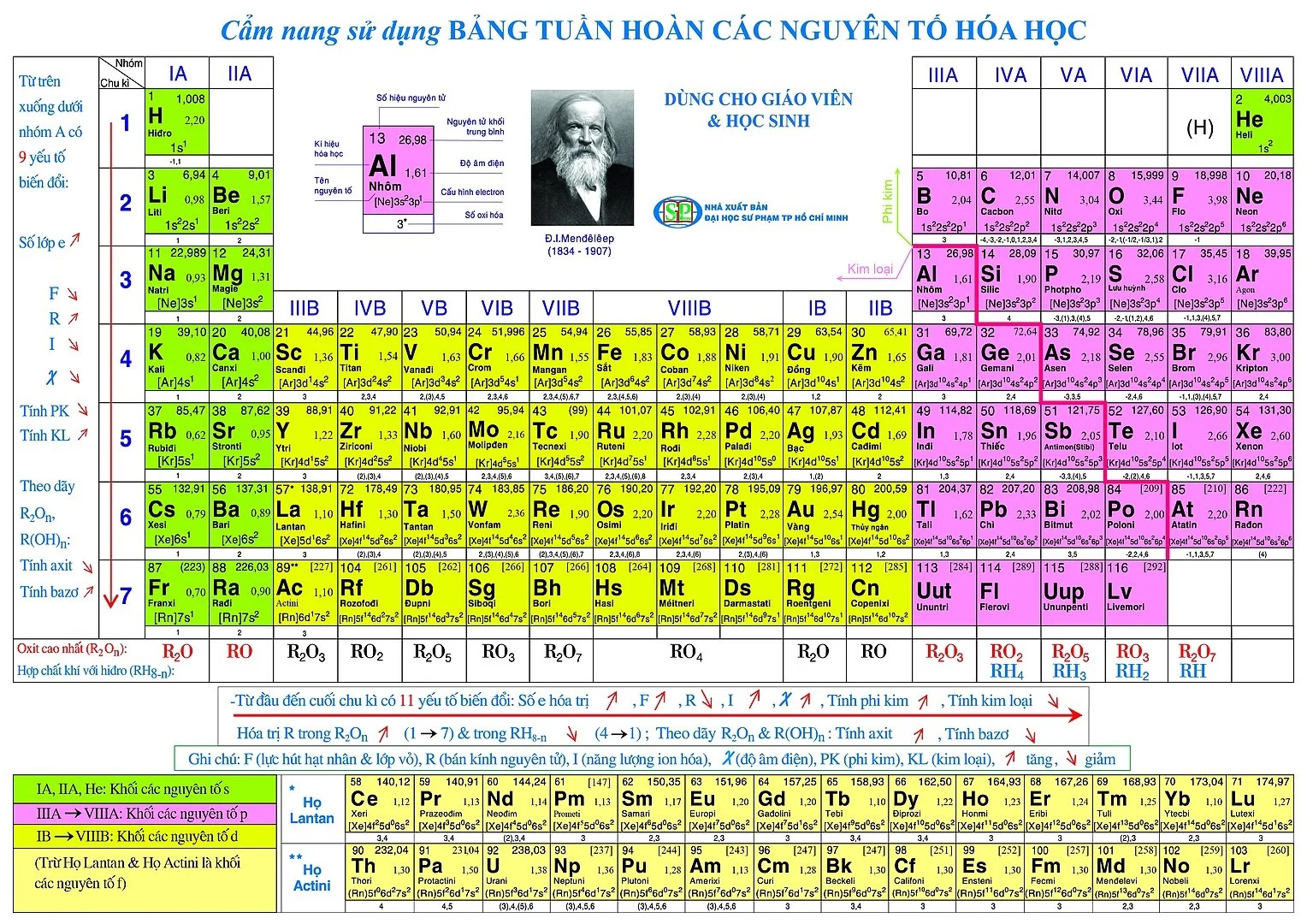
Bảng tuần hoàn (tên đầy đủ là Bảng tuần hoàn các nguyên tố hóa học, còn được biết với tên Bảng tuần hoàn Mendeleev), là một phương pháp liệt kê các nguyên tố hóa học thành dạng bảng, dựa trên số hiệu nguyên tử (số proton trong hạt nhân), cấu hình electron và các tính chất hóa học tuần hoàn của chúng. Các nguyên tố được biểu diễn theo trật tự số hiệu nguyên tử tăng dần, thường liệt kê cùng với ký hiệu hóa học trong mỗi ô. Dạng tiêu chuẩn của bảng gồm các nguyên tố được sắp xếp thành 18 cột và 7 dòng, với hai dòng kép nằm riêng nằm bên dưới cùng.
Các hàng trong bảng gọi là các chu kỳ, trong khi các cột gọi là các nhóm, một số có tên riêng như halogen hoặc khí hiếm. Bởi vì theo định nghĩa một bảng tuần hoàn thể hiện những xu hướng tuần hoàn, bất kỳ bảng dưới dạng nào cũng có thể dùng để suy ra mối quan hệ giữa các tính chất của nguyên tố và tiên đoán tính chất của những nguyên tố mới, chưa được khám phá hoặc chưa tổng hợp được. Do đó, một bảng tuần hoàn-dù ở dạng tiêu chuẩn hay các biến thể-cung cấp khuôn khổ hữu ích cho việc phân tích thuộc tính hóa học, và các bảng như vậy được sử dụng rộng rãi trong hóa học và các ngành khoa học khác.
Nguyên tắc sắp xếp trong bảng tuần hoàn các nguyên tố hóa học
Bảng hệ thống tuần hoàn hóa học hiện đã hoàn thiện với 118 nguyên tố với một dãy đầy đủ các thông tin. Các nguyên tố sẽ được sắp xếp từ trái qua phải, từ trên xuống dưới theo quy luật thứ tự tăng dần số hiệu nguyên tử. Đây là nguyên tắc sắp xếp trong bảng tuần hoàn các nguyên tố hóa học.
Các nguyên tố trong bảng tuần hoàn hóa học sẽ được xếp theo chiều tăng dần của điện tích hạt nhân.
Các nguyên tố giống nhau về lớp vỏ electron được đưa vào một hàng.
Các nguyên tố có cùng hóa trị thì đưa vào một nhóm.
Cấu tạo bảng tuần hoàn các nguyên tố hóa học
Ô nguyên tố
Bảng tuần hoàn nguyên tố hóa học gồm 118 nguyên tố, mỗi nguyên tố được xếp vào một ô nên gọi là ô nguyên tố.
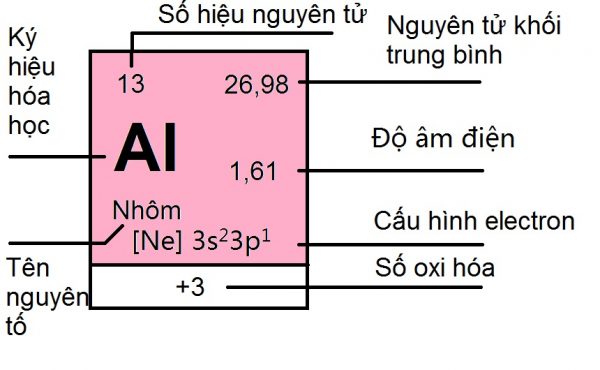
Số thứ tự của ô nguyên tố chính là số hiệu nguyên tử của nguyên tố đó. Vậy ô nguyên tố trong bảng tuần hoàn các nguyên tố hóa học cho biết điều gì? Đó là số hiệu nguyên tử( = số p = số e), kí hiệu hóa học, tên nguyên tố, nguyên tử khối, số oxi hóa,…
Chu kì
Chu kì trong bảng tuần hoàn hóa học là dãy các nguyên tố mà nguyên tử có cùng số lớp electron được xếp thành hàng ngang theo chiều tăng dần điện tích hạt nhân.
Số thứ tự chu kỳ bằng số lớp electron trong nguyên tử của nguyên tố nằm trong cùng một chu kỳ. Bảng tuần hoàn các nguyên tố hóa học hiện đang có 7 chu kì. Được chia thành chu kì nhỏ gồm chu kì 1,2,3 và chu kì lớn gồm chu kì 4,5,6.7. Riêng chu kì 7 là một chu kì chưa hoàn thành.
Nhóm nguyên tố
Nhóm nguyên tố được sắp xếp thành một hàng dọc trong bảng hệ thống tuần hoàn. Đây là sự tập hợp các nguyên tố mà nguyên tử có cấu hình electron trương tự nhau. Trong cùng một nhóm nguyên tố sẽ có tính chất hóa học gần giống nhau.
Bảng tuần hoàn các nguyên tố hóa học chia thành 2 loại nhóm nguyên tố: 8 nhóm A và 8 nhóm B
Nhóm A được đánh số từ IA đến VIIIA bao gồm các nguyên tố s và p. Quy luật là số thứ tự nhóm A sẽ bằng tổng số electron lớp ngoài cùng.
Nhóm B được đánh số IIIB đến VIIIB và IB và IIB theo chiều từ trái sang phải trong bảng tuần hoàn hóa học. Nhóm B gồm các nguyên tố d và f trong các chu kì lớn ở dạng (n – 1)dansb
Nếu (a + b) = 3 → 7 thì nguyên tố thuộc nhóm (a + b)B.
Nếu (a + b) = 8 → 10 thì nguyên tố thuộc nhóm VIIIB.
Nếu (a + b) > 10 thì nguyên tố thuộc nhóm (a + b – 10)B.
Sự biến đổi tính chất của nguyên tố trong bảng hệ thống tuần hoàn các nguyên tố hóa học
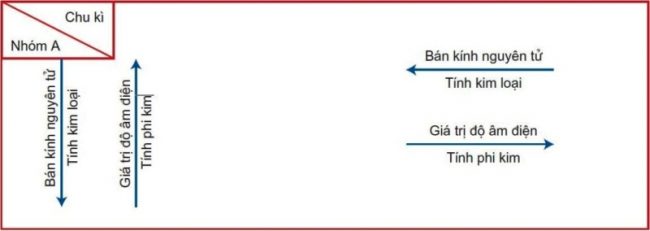
Trong một chu kì
Trong một chu kì theo chiều tăng dần của điện tích hạt nhân, tức là từ đầu đến cuối chu kì
Số electron ngoài cùng của nguyên tử các nguyên tố tăng dần từ 1 đến 8( trừ chu kì 1).
Tính kim loại của các nguyên tố yếu dần, thay vào đó tính phi kim sẽ mạnh dần.
Trong cùng một nhóm
Khi đi theo chiều tăng dần của điện tích hạt nhân từ trên xuống dưới
Số lớp electron của nguyên tử tăng dần
Các nguyên tố sẽ có tính kim loại tăng dần, tính phi kim yếu dần
Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
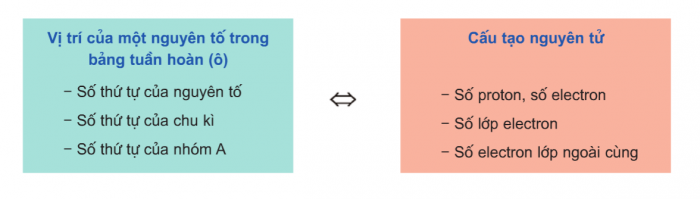
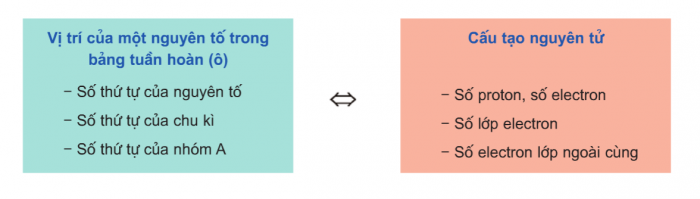
Quan hệ giữa vị trí và cấu tạo nguyên tử: Khi biết được vị trí của nguyên tố trong bảng tuần hoàn hóa học, ta có thể suy ra cấu tạo nguyên tử của nguyên tố đó và ngược lại.
Quan hệ giữa vị trí và tính chất của nguyên tố: Khi biết được vị trí của nguyên tố trong bảng hệ thống tuần hoàn các nguyên tố hóa học, ta có thể suy ra những tính chất hóa học cơ bản của nguyên tố đó.
So sánh tính chất hóa học của một nguyên tố với các nguyên tố lân cận nó: Dựa vào quy luật biến đổi tính chất trong một chu kì hay một nhóm nguyên tố có thể so sánh tính chất hóa học của nguyên tố đó với các nguyên tố lân cận.
Bảng tuần hoàn các nguyên tố hóa học được xem là cơ bản để có thể phát triển lên các kiến thức chuyên sâu hơn. Thông qua việc chia sẻ cấu tạo, các nguyên tắc cũng như quy luật của bảng tuần hoàn hóa học trên đây đã giúp bạn thêm phần nào nắm rõ và vận dụng tốt hơn vào bài tập.
Cách ghi nhớ bảng tuần hoàn hóa học 10
Sau đây là 2 cách giúp các bạn học sinh ghi nhớ tốt bảng tuần hoàn hóa học 10.
Nghiên cứu bảng tuần hoàn hóa học 10
Xác định bản chất các thành phần khác nhau của mỗi nguyên tố hóc học. Trong bảng tuần hoàn hóa học 10, mỗi một ô sẽ gồm nguyên tố gồm các thuộc tính, thành phần của nguyên tố đó. Vì thế, để tìm hiểu bảng tuần hoàn, bạn cần biết tên nguyên tố cùng ký hiệu hóa học, số nguyên tử… Tất cả các thông tin này đều có trong ô nguyên tố đó.
Ghi nhớ và thành thạo 10 nguyên tố đầu tiên trong bảng, bạn sẽ tìm ra quy luật cho các giá trị nguyên tố tiếp theo. Sau đó, bạn sử dụng phương pháp so sánh với giá trị đã học. Cứ như vậy, bạn sẽ học hết hơn 120 nguyên tố trong bảng tuần hoàn Mendeleev.
In bảng tuần hoàn hóa học 10 ra một bản màu dán để trong cặp
Bạn có thể in hoặc mua một bảng tuần hoàn, bạn sẽ mang đi mọi nơi và học bất cứ khi nào thuận tiện. Hãy in thật nhiều bản và dán những nơi cần thiết trong không gian học. Hãy ghim một tờ note trên bản dán nhiều lúc bạn phải ghi nhớ. Hoặc có thể chụp lại bản chính và để ở nơi bạn dễ quan sát. Thường xuyên mở ra xem để nhớ được lâu hơn. Có thể chia thành các phần nhỏ để học thay vì nhồi nhét quá nhiều nguyên tố.
Dùng phương pháp ghi nhớ bảng tuần hoàn hóa học 10
Dùng phương pháp ghi nhớ là viết một vài cụm từ, một vài câu giúp bạn nhớ nhanh hơn trong các nguyên tố hóa học. Phương pháp nhớ nhanh và dài nhất là thường xuyên làm bài tập hóa học và tra bảng tuần hoàn hóa học.
Cách nhớ dãy kim loại dễ dàng nhất: K Na Ca Mg Al Zn Fe Ni Sn Pb H Cu Hg Ag Pt Au – Khi nào cần may áo giáp sắt nhớ sang phố hỏi cửa hàng áo phi âu.
Kiến Guru đã gửi tới các bạn một số phương pháp giúp ghi nhớ lâu bảng tuần hoàn hóa học 10. Tuy nhiên, cách làm nhanh giúp bạn trở thành một người giỏi hóa thực thụ là thường xuyên giải các bài tập về hóa học, tra và xem các nguyên tố hóa học. Thực hiện các phương pháp cân bằng hòa học cần thiết.
Bài ca hóa trị dễ nhớ – hỗ trợ cho bảng hóa trị
Bài ca hóa trị số 1 cơ bản.
Bao gồm những chất phổ biến hay gặp:
Kali, Iot, Hiđro
Natri với Bạc, Clo một loài
Có hóa trị I bạn ơi
Nhớ ghi cho rõ kẻo rồi phân vân
Magie, Chì, Kẽm, Thủy ngân
Canxi, Đồng ấy cũng gần Bari
Cuối cùng thêm chú Oxi
Hóa trị II ấy có gì khó khăn
Bác Nhôm hóa trị III lần
Ghi sâu trí nhớ khi cần có ngay
Cacbon, Silic này đây
Là hóa trị IV không ngày nào quên
Sắt kia kể cũng quen tên
II, III lên xuống thật phiền lắm thay
Nitơ rắc rối nhất đời
I, II, III, IV khi thì là V
Lưu huỳnh lắm lúc chơi khăm
Lúc II, lúc VI khi nằm thứ IV
Photpho nói tới không dư
Nếu ai hỏi đến thì ừ rằng V
Bạn ơi cố gắng học chăm
Bài ca hóa trị suốt năm rất cần
Bài ca hóa trị số 2 chi tiết.
Hidro (H) cùng với Liti (Li)
Natri (Na) cùng với Kali (K) chẳng rời
Ngoài ra còn Bạc (Ag) sáng ngời
Chỉ mang hoá trị I thôi chớ nhầm
Riêng Đồng (Cu) cùng với Thuỷ ngân (Hg)
Thường II ít I chớ phân vân gì
Đổi thay II, IV là Chì (Pb)
Điển hình hoá trị của Chì (Pb) là II
Bao giờ cùng hoá trị II
Là Oxi (O), Kẽm(Zn) chẳng sai chút gì
Ngoài ra còn có Canxi (Ca)
Magie (Mg) cùng với Bari (Ba) một nhà
Bo (B), Nhôm (Al) thì hóa trị III
Cacbon (C), Silic (Si), Thiếc (Sn) là IV thôi
Thế nhưng phải nói thêm lời
Hóa trị II vẫn là nơi đi về
Sắt (Fe) II toan tính bộn bề
Không bền nên dễ biến liền sắt III
Photpho (P) III ít gặp mà
Photpho (P) V chính người ta gặp nhiều
Nitơ (N) hoá trị bao nhiêu ?
I, II, III, IV phần nhiều tới V
Lưu huỳnh (S) lắm lúc chơi khăm
Khi II lúc IV, VI tăng tột cùng
Clo Iot lung tung
II III V VII thường thì I thôi
Mangan (Mn) rắc rối nhất đời
Đổi từ I đến VII thời mới yên
Hoá trị II cũng dùng nhiều
Hoá trị VII cũng được yêu hay cần
Bài ca hoá trị thuộc lòng
Viết thông công thức đề phòng lãng quên
Học hành cố gắng cần chuyên
Siêng ôn chăm luyện tất nhiên nhớ nhiều.